福岡教育大学 化学教室
宮崎研究室
宮崎研究室では,ホウ素やバナジウムなどのオキソ酸の溶液内反応について研究しています。反応化学種の化学量論の確立 ⇒ 量子化学的アプローチによる溶存化学種の構造決定 ⇒ 錯形成メカニズムの解明,といった綿密な平衡論的・速度論的・構造化学的検討によって得られる知見を積み上げていくことにより,その全容を解明してきました。また,オキソ酸選択性ゲルの吸着メカニズムの解明と吸着化学種の状態分析にも取り組んでいます。
ホウ酸と糖アルコールの溶液内反応
鎖長の異なる糖アルコールとホウ酸の溶液内反応について,11B,13C NMR 法,電位差滴定法,DFT 計算を用いて研究しました。この錯生成系において一般的に認識されている 1:1 五員環モノキレート錯体,1:2 五員環ビスキレート錯体,1:1 六員環モノキレート錯体,1:2 六員環ビスキレート錯体,1:2 五員環六員環ビスキレート錯体に加えて,「 1:1 単座錯体,1:1 五員環六員環ビスキレート錯体,1:1 六員環ビスキレート錯体,1:2 五員環モノキレート/単座錯体,1:2 六員環モノキレート/単座錯体が生成すること 」を明らかにしました。錯生成反応のエンタルピー変化は全て発熱であり,六員環錯体が五員環錯体に比べてより発熱でした。一方,エントロピー変化はほとんどの錯生成反応で負の値となり,六員環錯体がより負の値でした。興味深いことに,1:1 および 1:2 錯生成反応に対する TΔS° vs. ΔH° プロットは,五員環錯体であるか六員環錯体であるかにかかわらず,大部分の錯体に対して,キレート環外の水酸基数(0 個,1 個および 2 個)に応じて,ほぼ平行な線形の相補関係を与えました。また,この直線関係は水酸基数とともに錯生成に有利な方向へ(TΔS° について,約 5 kJ/mol)シフトしました。このシフトはキレート環外水酸基部分の回転の自由度によるエントロピー的な寄与と水素結合によるエンタルピー的な寄与によるものと考えられます。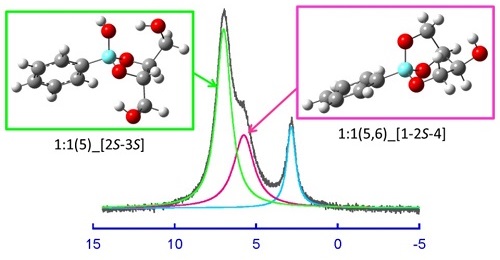 トレイトールおよびエリトリトールの 1:1五員環錯体には,C1-C2 位または C2-C3 位で結合した二種類がありますが,トレイトールでは,C2-C3 位で結合した threo 型錯体が C1-C2 位で結合した錯体より安定でした。一方,エリトリトールでは 1-2R で結合した錯体が 2R-3S 位で結合した erythro 型錯体より安定でした。これらの安定度の差異はもっぱらエントロピー変化の差に帰せられるものです。
トレイトールおよびエリトリトールの 1:1五員環錯体には,C1-C2 位または C2-C3 位で結合した二種類がありますが,トレイトールでは,C2-C3 位で結合した threo 型錯体が C1-C2 位で結合した錯体より安定でした。一方,エリトリトールでは 1-2R で結合した錯体が 2R-3S 位で結合した erythro 型錯体より安定でした。これらの安定度の差異はもっぱらエントロピー変化の差に帰せられるものです。
架橋デキストランに対するホウ素の吸着
ホウ素は動植物にとって必須元素ですが,許容範囲が狭く,過剰に摂取すると毒性を示します。人に対しては,腹痛,下痢,吐き気,嘔吐などの健康被害を引き起こす場合があります。WHO は,飲料水中のホウ素濃度(健康基準の指針値)を 2.4 ppm 以下に設定しています。日本では,ホウ素の環境水質基準は 1.0 ppm,排水中の濃度は 10 ppm 未満(海域では 230 ppm 未満)に設定されています。福岡市は,安定した水資源を確保するため,日本最大の海水淡水化プラント(逆浸透膜ろ過法により海水を真水に変換)を稼動しています。しかし,この方法で処理された水には環境水質基準を超えるホウ素が含まれており(海水中のホウ素(約 4.8 ppm)が逆浸透膜ろ過法では除去されないため),そのままでは上水として用いることはできません。このような状況を受けて,ホウ素を効率良く簡便に吸着・除去する技術の必要性が高まっています。ホウ素の溶液内反応の全容を解明し,様々な目的に適したホウ素吸着剤の開発を可能にする指導原理を構築することが必要です。
ホウ酸は架橋デキストランに吸着されるが,その吸着挙動は次のように報告されています。
「 ホウ酸の吸着量は,pH の上昇とともに増加するが,pH 10 付近で最大となり,さらに高い pH では減少する。また,ホウ素濃度の低下とともに吸着力は増加する。」
しかし,この特異な挙動の発現メカニズム,ホウ素吸着サイト,吸着化学種の構造については不明でした。私たちは,ホウ酸陰イオンと架橋デキストランとの錯生成反応を考慮し,Gibbs-Donnan 理論からゲル中のホウ酸の酸解離定数と水素イオン濃度の比を推定することにより,特異なホウ素の吸着挙動を再現することに成功しました。このシミュレーション結果,モノマーアナログ配位子とホウ素との錯生成能,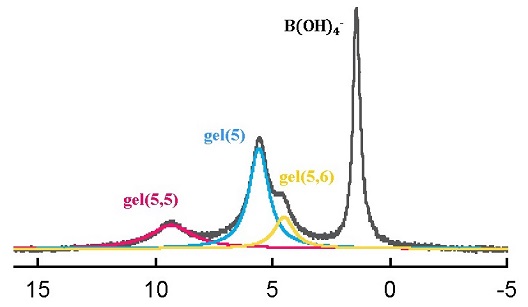 およびホウ素吸着能の温度依存性から得られた熱力学パラメータの結果から,ホウ素の吸着サイトは,架橋デキストランの主要構成単位であるグルコピラノシドではなく,デキストランC1末端由来のグルコン酸残基と架橋剤(エピクロロヒドリン)が意図しない形で反応してできたグリセロール残基であることが分かりました。さらに,主なホウ素吸着化学種は,五員環モノキレート錯体,五員環六員環ビスキレート錯体および五員環ビスキレート錯体であることを明らかにしました。
およびホウ素吸着能の温度依存性から得られた熱力学パラメータの結果から,ホウ素の吸着サイトは,架橋デキストランの主要構成単位であるグルコピラノシドではなく,デキストランC1末端由来のグルコン酸残基と架橋剤(エピクロロヒドリン)が意図しない形で反応してできたグリセロール残基であることが分かりました。さらに,主なホウ素吸着化学種は,五員環モノキレート錯体,五員環六員環ビスキレート錯体および五員環ビスキレート錯体であることを明らかにしました。
バナジウム(V)オキソ酸と窒素・酸素含有多座配位子の錯生成反応
バナジウム(V)オキソ酸は,リン酸と同様に四面体構造をとり,類似の酸解離(非解離の H3VO4 から完全解離の VO43- へ連続的に酸解離)します。一方, H3VO4 は,リン酸とは異なり,水溶液中で水素イオンと結合して,六配位八面体形の VO2(H2O)4+ を形成する。また,バナジウム(V)オキソ酸は錯生成反応においても,リン酸と異なり,水溶液中で容易に五配位や六配位の錯体を形成します。これらは,バナジウム(V)オキソ酸が水溶液中でルイス酸として働くためです。私たちは,51V NMR 法,紫外吸収スペクトル法,電位差滴定法,DFT 計算を用いて,バナジウム(V)オキソ酸の溶液内反応,生成錯体の溶存構造について研究しました。ジエタノールアミン(DEA)では,N 原子で配位し,2 個のアルコール性水酸基で脱水縮合した組成 1:1 の三方両錐形錯体 [NEtOEtO]tbp を生成します。また,イミノ二酢酸(IDA)でも,N 原子で配位し,2 個のカルボキシ基で脱水縮合した三方両錐形錯体 [NAcOAcO]tbp を生成します。しかし,この錯体は N 原子上の H 原子と同一方向のバナジウムアピカル位に配位空間が確保された歪んだ三方両錐形構造であることが分かりました。このため,H 原子を配位可能な第三の官能基,例えば,-CH2COO- や -CH2CH2OH で置き換えた NTA または HIDA では,これらの官能基が容易にバナジウムに配位し,非常に安定な八面体形錯体 [NAcOAcO|AcO|]oct および [NAcOAcO|EtOH|]oct を生成することが分かりました( |AcO| および |EtOH| は脱水を伴わない配位を示す)。すなわち,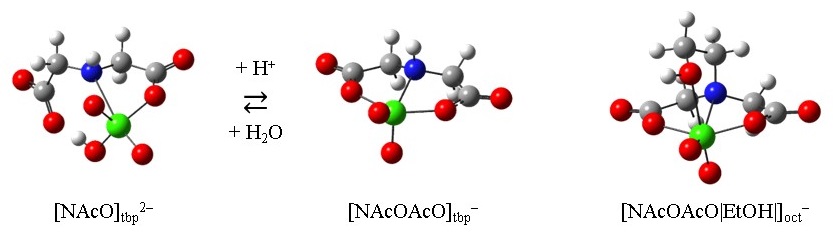 IDA 類縁体は八面体形錯体を形成しやすい配位子,DEA 類縁体は三方両錐形錯体を形成しやすい配位子であると言えます。このように一連の配位子の錯生成反応を詳細に検討することにより,配位子の特徴と生成錯体の構造・安定度に明確な相関があることが分かりました。
IDA 類縁体は八面体形錯体を形成しやすい配位子,DEA 類縁体は三方両錐形錯体を形成しやすい配位子であると言えます。このように一連の配位子の錯生成反応を詳細に検討することにより,配位子の特徴と生成錯体の構造・安定度に明確な相関があることが分かりました。